Definição
A síndrome do desconforto respiratório agudo (SDRA) é uma condição com risco de vida caracterizada pelo início súbito de dispneia grave e hipoxemia [1] .
Em 1994, a Conferência de Consenso Americano-Europeu [2] definiu o ARDS como:
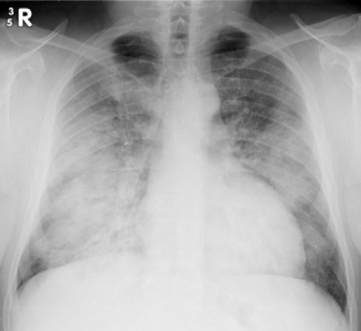
O início agudo da hipoxemia (pressão arterial parcial de oxigênio para fração inspirada de oxigênio [PaO2 / FiO2] menor ou igual a 200mmHg) com infiltrados bilaterais na radiografia torácica frontal, sem evidência de hipertensão atrial esquerda.
Lesão pulmonar aguda (LPA) também foi descrita usando critérios semelhantes, mas com hipoxemia menos grave (PaO2 / FiO2 menor ou igual a 300mmHg)
Mais recentemente, a Sociedade Européia de Medicina Intensiva, com o endosso da Sociedade Torácica Americana e da Sociedade de Medicina Critical Care, organizou um painel de especialistas para abordar as limitações da definição da AECC. Como resultado, a Definição de Berlim [3] foi criada e é mostrada abaixo:
A SDRA é tipicamente uma condição secundária e é induzida pela inflamação da interface alvéolo-capilar, que resulta na entrada de proteínas e líquidos no espaço intersticial e nos alvéolos. Esse infiltrado pulmonar pode levar à insuficiência respiratória ou, em aproximadamente 20-30% dos casos de SDRA, morte [4] .
Embora os pulmões sejam o principal local de disfunção para um indivíduo com SDRA, muitos dos outros sistemas estarão comprometidos devido à diminuição dos níveis de oxigênio no sangue [5] . Como a SDRA pode ocorrer em um indivíduo de qualquer idade, o impacto sistêmico da condição também pode resultar em complicações sérias mais tarde na vida do indivíduo.
Processo Patológico
| Direto | Indireto |
|---|---|
| Pneumonia | Sepse não pulmonar |
| Aspiração do conteúdo gástrico | Trauma múltiplo |
| Contusão pulmonar | Transfusão maciça |
| Embolia gordurosa | Pancreatite |
| Perto de afogar | Bypass cardiopulmonar |
| Lesão por inalação | |
| Lesão de Reperfusão |
O mecanismo exato de patogênese da SDRA é desconhecido, embora seja bem aceito que há dano alveolar difuso com:
- Danos da barreira alvéolo-capilar levando a edema pulmonar.
- Um complexo sistema de infiltrados inflamatórios
Antes destas alterações, o volume de negócios de surfactante é significativamente aumentado e o fluido que reveste o epitélio também destaca a alveolite fibrosante no início do curso dos danos pulmonares.
Uma vez que a membrana alveolocapilar esteja danificada, há vazamento bidirecional de fluidos e proteínas para o alvéolo e também proteínas surfactantes e citocinas alveolares para o plasma. A barreira epitelial é interrompida com uma proliferação de células alveolares tipo 2, levando à disfunção do surfactante.
Envolvimento Celular na SDRA
- Neutrófilos : Mais abundante no revestimento epitelial e nas amostras histológicas alveolares. Embora a natureza quimiotáxica dos neutrófilos que atravessam o epitélio não cause danos, sua natureza pró-inflamatória libera espécies reativas de oxigênio, citocinas e vários mediadores inflamatórios que contribuem para o dano na membrana basal.
- Macrófagos alveolares: são o tipo de célula mais comum e com macrófagos intersticiais desempenham um papel importante na defesa. Em pacientes com SDRA, há um aumento progressivo no número de macrófagos alveolares.
- Epitélio : Contido dentro do tecido epitelial alveolar estão as células alveolares do tipo 2 altamente metabolicamente ativas. Epitélio danificado leva a surfactante disfuncional
A prevalência de pessoas que sofrem de SDRA difere muito entre áreas geográficas. Embora a razão para as diferenças não seja clara, alguns especularam que ela pode derivar das diferenças nos sistemas de saúde [6] . A capacidade de diagnosticar e diferenciar a condição secundária é necessária para registrar e tratar adequadamente o paciente. Estudos futuros devem ser conduzidos para melhorar a capacidade de diagnosticar com precisão a SDRA.
Apresentação clínica
- Fase Inflamatória Aguda: Dura 3 a 10 dias e resulta em hipoxemia e falência múltipla de órgãos. Os pacientes geralmente apresentam dispneia progressiva, taquipneia, cianose, confusão hipóxica e crepitações pulmonares.
- Cura, Fase Proliferativa: Durante esta fase, cicatrizes nos pulmões e pneumotorácicos são comuns.
Vale ressaltar que, em ambas as fases, podem ocorrer infecções sistêmicas e pulmonares secundárias.
Procedimentos de diagnóstico
De acordo com o Instituto Nacional do Coração, Pulmão e Sangue [7], um diagnóstico será feito através do exame de seu histórico médico, exame físico e resultados de exames.
HISTÓRICO MÉDICO
- História de insuficiência cardíaca
- O paciente teve algum fator de risco clínico direto ou indireto para SDRA?
EXAME FÍSICO
- Adicionado sons respiratórios na auscultação (por exemplo, crepitação)
- Ausculta cardíaca
- Cianose
RESULTADO DOS TESTES
Gestão / Intervenções
Para este tipo de paciente, você deve considerar o risco versus recompensa de sua intervenção, particularmente quando os pulmões são tão frágeis quanto eles são. No entanto, possíveis intervenções para o paciente com SDRA podem incluir:
Hiperinflação do Ventilador (VHI)
Uma revisão sistemática feita por Anderson et al (2015) [8] considerou que tanto a hiperinsuflação manual quanto a ventilatória têm afetos similares na depuração de secreções, na complacência pulmonar, na melhora das atelectasias e na oxigenação sem risco prejudicial à estabilidade cardiovascular. No entanto, um manômetro deve ser usado durante toda a intervenção, com especial atenção às contra-indicações.
Devido aos altos níveis de PEEP que são necessários para manter o recrutamento pulmonar para um paciente com SDRA, o uso do ventilador para fornecer a hiperinsuflação é ideal. Além disso, o VHI permite o monitoramento e monitoramento constante das pressões das vias aéreas, permitindo que a entrega seja titulada de acordo.
Posicionamento propenso
Colocar o paciente com SDRA em propensão resultará em um aumento significativo da PaO2 em aproximadamente 70% dos pacientes. Ao colocar o paciente em pronação, há uma melhora no recrutamento do aspecto dorsal do pulmão, resultando em uma perfusão distribuída mais uniformemente e melhorando a correspondência V / Q.
Evidências demonstram que o posicionamento em prono é benéfico, particularmente naqueles com SDRA severamente hipoxêmica / grave, com reduções na mortalidade na UTI sem aumento das complicações das vias aéreas.
- Explique ao paciente, com segurança, que eles estarão seguros e obterão consentimento se puderem se comunicar.
- Feche os olhos e proteja com gel ou almofada.
- Coloque as palmas das mãos do paciente contra as coxas, polegares para cima, cotovelos retos e ombros neutros.
- Deslize o paciente até a borda usando uma folha deslizante.
- Role o paciente para a posição lateral usando a folha de baixo.
- Enrole o paciente em propenso.
- ‘Posição dos nadadores’ – o cotovelo no qual a cabeça é semi-girada deve ser flexionado a não mais do que 90 ° para evitar o estiramento do nervo ulnar, e o outro braço girado internamente pelo lado.
- Certifique-se de que os seios das mulheres ou os genitais masculinos não estejam comprimidos.
- Coloque dois travesseiros sob cada canela para evitar o alongamento do nervo fibular, posicionando-os para evitar a pressão do joelho e dos dedos do colchão.
Ventilação mecânica
Como resultado do início agudo da insuficiência respiratória hipoxêmica com um trabalho aumentado de respiração, a ventilação mecânica é comum. A fisiopatologia da SDRA e, em particular, o aspecto fibrosante significa que o método e a entrega do suporte requerem cuidadosa consideração para garantir que a lesão pulmonar induzida pelo ventilador (VLII) não ocorra [9]
No paciente com SDRA, a PEEP e o volume corrente devem ser reduzidos para refletir as partes disponíveis do pulmão que estão disponíveis para aeração. Caso contrário, isso pode levar a um alongamento excessivo do pulmão, conhecido como volutrauma, devido à diminuição da complacência pulmonar. A abertura e o fechamento repetidos dos alvéolos durante a inflação da maré também podem causar danos ao tecido pulmonar, conhecidos como alectotrauma. Se o suporte mecânico não for titulado para o paciente, tanto o alototrauma quanto o volutrauma podem aumentar as citocinas dentro do tecido pulmonar, que então podem entrar na circulação sistêmica e potencialmente levar à falência múltipla de órgãos. [9]
Embora talvez excessivamente simplificado, o gráfico abaixo tenta destacar a área ideal para ventilação do paciente com SDRA. Acredita-se que o ponto de inflexão inferior (LIP) seja a pressão na qual o tecido pulmonar é recrutado. O ponto de inflexão superior (UIP) é a pressão aproximada na qual os alvéolos ficam distendidos, o que pode potencialmente levar a danos. Portanto, a posição mais ideal para ventilar seria entre os dois pontos de inflexão, no aspecto mais complicado da curva [10] .
Ventilação de relação inversa (IRV)
Este modo de ventilação requer a alteração da relação inspiratória / expiratória normal de 1: 2 para 1: 1 ou 2: 1. Embora esse modo de ventilação tenha como objetivo aumentar a aeração e a ventilação colateral do pulmão pouco compatível, a diminuição do tempo de expiração pode resultar em um aumento na PCO2. No entanto, se a acidose hipercápnica ocorrer lentamente, a acidose intracelular será bem compensada, entretanto, qualquer forma de hipercapnia deve ser evitada com ou naquelas com risco de desenvolver pressões intracranianas elevadas. Isso é conhecido como hipercapnia permissiva.
Um estudo recente, embora pequeno, de Kotani et al (2016) [11] mostrou que o IRV proporcionou trocas gasosas aceitáveis sem complicações para 13 pessoas com SDRA.
Ventilação de Liberação de Pressão nas Vias Aéreas (APRV)
Esta forma de ventilação mecânica envolve a entrega de CPAP com uma fase de liberação intermitente. Considera-se que a administração de CPAP por longos períodos mantenha o volume pulmonar adequado e o recrutamento alveolar onde a liberação é projetada para ajudar na remoção de CO2. A inspiração começa a partir de uma relação mais benéfica pressão-volume, ajudando assim a oxigenação [12] .
Oscilação de Alta Freqüência (HFO)
Com o HFO, uma pressão contínua de distensão (CDP) é definida e pequenos volumes correntes são entregues em altas freqüências com uma bomba oscilatória. Como os outros descritos anteriormente, essa é outra forma de ventilação protetora pulmonar com constante recrutamento pulmonar. Enquanto uma revisão sistemática por Sud et al (2010) [13] descobriu que HFO pode melhorar a sobrevida e é improvável que cause danos, apenas 8 estudos foram analisados com poucos pacientes e intervalos de confiança amplos. Também não houve relatos de cegos avaliadores de resultados, colocando os ensaios em risco de viés [13] .
A ECMO pode ser usada para pacientes com insuficiência respiratória grave e é usada quando a terapia convencional não consegue manter a oxigenação adequada. A ECMO pode substituir totalmente a função dos pulmões, no entanto, devido a várias complicações, é necessário considerar o risco versus benefício.
A ECMO consiste em um circuito sangüíneo extracorpóreo formado por um oxigenador e uma bomba. Dois acessos vasculares são estabelecidos, um remove o sangue venoso e um infunde o sangue oxigenado. Depois que o sangue foi removido de uma veia principal, ele é bombeado através de um circuito que contém um oxigenador que oxigena o sangue e remove o dióxido de carbono. O sangue é então devolvido pela outra cânula [14] .
Óxido Nítrico Inalado
O óxido nítrico não é apenas um relaxante do músculo liso derivado do endotélio, mas também ajuda na neurotransmissão, na defesa do hospedeiro, na agregação plaquetária e na broncodilatação. O óxido nítrico inalado pode ser administrado continuamente ou através de injeção inspiratória intermitente e um aumento na PaO2 de 20% é considerado uma resposta positiva. 40% – 70% dos pacientes com SDRA têm melhorado a oxigenação após o óxido nítrico inalado e é comumente usado em pacientes com hipoxemia grave como resgate temporário. [9]
Papel do fisioterapeuta
A entrada da fisioterapia é muitas vezes limitada e mínima, muitas vezes devido à necessidade de alta PEEP e alta necessidade de oxigênio. Como é uma secreção patológica intersticial, geralmente não é um problema. O tratamento pode consistir apenas em posicionamento, por exemplo, deitado para otimizar a troca gasosa. É necessário ter cuidado com as técnicas práticas, para garantir que você não recruta as unidades pulmonares, perdendo o efeito de imobilização do PEEP do ventilador. Se as secreções se tornarem um problema, garanta a umidificação adequada junto com outras técnicas para melhorar a depuração do escarro. Aspiração mínima via ETT.
Recursos
Referências
- Gibbons, C. Acute Respiratory Distress Syndrome. ↑ Gibbons, C. Síndrome da Angústia Respiratória Aguda. Tecnologia Radiológica 2015; 86 (4): 419-436
- Bernard GR, Artigas A, Brigham KL, et al. ↑ Bernard GR, Artigas A, Brigham KL, e outros. A Conferência de Consenso Americano-Europeu sobre SDRA: definições, mecanismos, resultados relevantes e coordenação do ensaio clínico. Am J Respir Crit Care Med. 1994; 149 (3 pt 1): 818-824.
- Force, ADT, Ranieri, VM and Rubenfeld, GD, 2012. Acute respiratory distress syndrome. ↑ Força, ADT, Ranieri, VM e Rubenfeld, GD, 2012. Síndrome do desconforto respiratório agudo. Jama , 307 (23), pp. 2526-2533.
- Hough, A. 2014. Physiotherapy in respiratory and cardiac care: an evidence-based approach. ↑ Hough, A. 2014. Fisioterapia no atendimento respiratório e cardíaco: uma abordagem baseada em evidências. Cengage Learning. 4ª Edn.
- National Institutes of Health Services. ↑ Institutos Nacionais de Serviços de Saúde. ARDS. Disponível em Walkey, A., Summer, R., Vu. ↑ Walkey, A., Summer, R., Vu.
- National Heart, Lung and Blood Institute (2018). ↑ Instituto Nacional do Coração, Pulmão e Sangue (2018). ARDS. Disponível em: Anderson, A., Alexanders, J., Sinani, C., Hayes, S. and Fogarty, M., 2015. Effects of ventilator vs manual hyperinflation in adults receiving mechanical ventilation: a systematic review of randomised clinical trials. ↑ Anderson, A., Alexanders, J., Sinani, C., Hayes, S. e Fogarty, M., 2015. Efeitos de ventilação contra hiperinflação manual em adultos que recebem ventilação mecânica: uma revisão sistemática de ensaios clínicos randomizados. Fisioterapia , 101 (2), pp. 103-110.
- Bernsten, A. and Soni. 9,09,19,2 Bernsten, A. e Soni. S. (2014). Manual de cuidados intensivos do OH. 7ª edição. Elsevier LTD.
- Moloney, ED and Griffiths, MJD, 2004. Protective ventilation of patients with acute respiratory distress syndrome. ↑ Moloney, ED e Griffiths, MJD, 2004. Ventilação protetora de pacientes com síndrome de aflição respiratória aguda. British Journal of Anesthesia , 92 (2), páginas 261-270.
- Kotani, T., Katayama, S., Fukuda, S., Miyazaki, Y. and Sato, Y., 2016. Pressure-controlled inverse ratio ventilation as a rescue therapy for severe acute respiratory distress syndrome. ↑ Kotani, T., Katayama, S., Fukuda, S., Miyazaki, Y. e Sato, Y., 2016. Ventilação de razão inversa controlada por pressão como terapia de resgate para síndrome do desconforto respiratório agudo grave. SpringerPlus , 5 (1), p.716.
- Daoud, EG, 2007. Airway pressure release ventilation. ↑ Daoud, EG, 2007. Ventilação de liberação de pressão nas vias aéreas. Anais de medicina torácica , 2 (4), p.176.
- Sud, S., Sud, M., Friedrich, JO, Meade, MO, Ferguson, ND, Wunsch, H. and Adhikari, NK, 2010. High frequency oscillation in patients with acute lung injury and acute respiratory distress syndrome (ARDS): systematic review and meta-analysis. ↑ 13,013,1 Sud, S., Sud, M., Friedrich, JO, Meade, MO, Ferguson, ND, Wunsch, H. e Adhikari, NK, 2010. Oscilação de alta frequência em pacientes com dano pulmonar agudo e síndrome de aflição respiratória aguda (ARDS): revisão sistemática e meta-análise. Bmj , 340 , p.c2327.
- Aokage, T., Palmér, K., Ichiba, S. and Takeda, S., 2015. Extracorporeal membrane oxygenation for acute respiratory distress syndrome. ↑ Aokage, T., Palmér, K., Ichiba, S. e Takeda, S., 2015. Oxigenação por membrana extracorpórea para síndrome do desconforto respiratório agudo. Revista de cuidados intensivos , 3 (1), p.17.
H., Alkana, P. Síndrome do desconforto respiratório agudo: epidemiologia e abordagens de gestão. Epidemiologia Clínica 2012; 4: 159-169