Introdução
O Ligamento Cruzado Anterior (LCA) é uma estrutura fundamental na articulação do joelho, pois resiste à translação anterior da tíbia e às cargas rotacionais. [1] É uma das estruturas mais freqüentemente lesadas durante atividades de alto impacto ou esportivas. [2] O LCA não cicatriza quando rompido e a reconstrução cirúrgica é o tratamento padrão no campo da medicina esportiva. [3] Essa reconstrução visa restaurar a cinemática e a estabilidade do joelho lesionado, para evitar futuras alterações degenerativas. [4][5] Portanto, uma compreensão adequada da complexa anatomia, função e biomecânica do LCA é fundamental para elucidar os mecanismos da lesão, entender o destino da deficiência crônica do LCA e melhorar a reconstrução cirúrgica.
Desenvolvimento do ACL
O joelho origina-se do mesênquima vascular femoral e tibial na quarta semana de gestação entre o blastoma do fêmur e a tíbia. [6][7] Por 9 semanas, os ligamentos cruzados são compostos de numerosos fibroblastos imaturos com citoplasma escasso e núcleos fusiformes. [8] Após a semana 20, o desenvolvimento restante consiste em crescimento acentuado com pouca mudança na forma. Nesses estágios, dois feixes principais já são detectáveis, mas os feixes pareciam mais paralelos quando comparados com a orientação do feixe do adulto ACL. [9] Ela é circundada por uma dobra mesentérica da sinóvia que se origina do aparato capsular posterior da articulação do joelho. Assim, enquanto o LCA está localizado intra-articularmente, ele permanece extra-sinovial ao longo de seu curso. [10]
A manifestação precoce do LCA com dois feixes diferentes no joelho fetal sugere que o desenvolvimento precoce da articulação do joelho é guiado pelo LCA. Os ligamentos cruzados presentes neste estágio inicial do desenvolvimento podem levar à suposição de que eles interagem com a forma resultante dos côndilos femorais e do planalto tibial. [5]
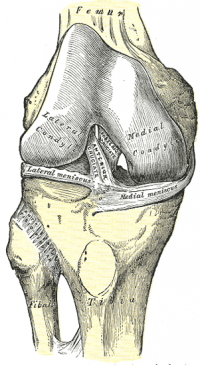
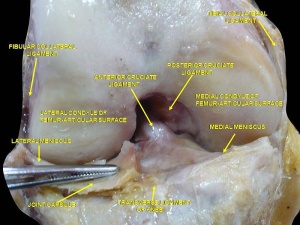
Anatomia Bruta
Acessório Femoral
O ACL é uma estrutura semelhante à banda de tecidos conjuntivos densos. O LCA está ligado a uma fossa na face posterior da face medial do côndilo femoral lateral. [11][7] O implante femoral tem a forma de um segmento de um círculo, com a borda anterior reta e a borda posterior convexa. Seu longo eixo é inclinado ligeiramente para a frente a partir da vertical, e a convexidade posterior é paralela à margem articular posterior do côndilo femoral lateral. [11] A partir do seu encaixe femoral, o LCA corre anteriormente, medialmente e distalmente à tíbia. Seu comprimento varia de 22 a 41 mm (média de 32 mm) e sua largura de 7 a 12 mm. [12]
Anexo Tibial
O LCA é conectado a uma fossa na frente e lateral da espinha tibial anterior. Neste apego, o LCA passa abaixo do ligamento meniscal transverso e alguns fascículos do LCA podem se misturar com a fixação anterior do menisco lateral. Em alguns casos, os fascículos do aspecto posterior da fixação tibial do LCA podem se estender e se misturar com a fixação posterior do menisco lateral. A fixação tibial do LCA é um pouco mais larga e mais forte que o implante femoral. [11] A área da seção transversal aumenta do fêmur para a tíbia, como segue: 34 mm2 proximalmente, 33 mm2 médio-proximalmente, 35 mm2 no nível médio da substância, 38 mm2 no meio distal e 42 mm2 distalmente. [13] Eles também relataram que a inserção tibial do LCA é de aproximadamente 120% do local da inserção femoral. [14]
Orientação espacial
A literatura torna-se confusa quando a anatomia fascicular é categorizada. Welsh (1980) e Arnoczky (1983) descreveram o LCA como sendo o único continuum largo dos fascículos, com diferentes partes esticadas ao longo da amplitude de movimento. [15][16] No entanto, funcionalmente, Girgis et al. dividiram o LCA em duas partes, o feixe ântero-medial (AMB) e o feixe posterolateral (PLB), [11] enquanto outros autores separaram o LCA em três feixes funcionais (AMB, faixa intermediária e PLB). [12][17] Um estudo recente que utilizou a simulação de ressonância magnética e a visualização em 3D observou três feixes em 22 joelhos (92%) e dois feixes em 2 joelhos (8%) dos sujeitos do estudo [18] . No entanto, o modelo de dois pacotes foi geralmente aceito como a melhor representação para entender a função da ACL.
O LCA circula anteriormente, medial e distalmente ao longo da articulação ao passar do fêmur para a tíbia. Quando isso acontece, ele se transforma em uma leve espiral externa (lateral). Isto é devido à orientação de seus anexos ósseos. A orientação da fixação femoral do LCA, no que diz respeito à posição articular (flexão / extensão), também é responsável pela tensão relativa do ligamento ao longo da amplitude de movimento. [7]
O LCA está preso ao fêmur e à tíbia, não como um cordão singular, mas como uma coleção de fascículos individuais que se espalham por uma ampla área achatada. [11] Estes fascículos foram sumariamente divididos em dois grupos; a banda ântero-medial (AMB), os fascículos que se originam no aspecto proximal da inserção femoral e inserção no aspecto anteromedial da fixação tibial, e o bulk póstero-lateral (PLB), o volume restante de fascículos, que são inseridos no aspecto posterolateral do apego tibial. No plano frontal, a AMB tem uma orientação mais vertical (aproximadamente 70 ° em relação à linha de base do joelho), enquanto o PLB é orientado mais horizontalmente (aproximadamente 55 ° em relação à linha de base do joelho). [7] Quando o joelho é estendido, o PLB é apertado, enquanto o AMB é moderadamente frouxo. No entanto, como o joelho é flexionado, a fixação femoral do LCA assume uma orientação mais horizontal, fazendo com que o AMB aperte e o PLB se solte e, assim, deixe o AMB como restrição à carga tibial anterior. [11] A rotação interna aumenta o ACL um pouco mais do que a rotação externa, mais notadamente a 30 ° de flexão. Além disso, Markolf et al. relataram que o LCA atua como uma restrição secundária à angulação varo-valgo em extensão total. [19] A torção é resistida por uma combinação de cisalhamento capsular, ação ligamentar colateral oblíqua, superfície articular e geometria meniscal, enquanto os cruzados desempenham apenas um papel secundário. [1]
Enquanto a designação de dois grupos fornece uma idéia geral sobre a dinâmica do ACL através da amplitude de movimento, ele simplifica um pouco. Enquanto um AMB funcional é definido em flexão e um PLB está presente em extensão, o LCA é, na verdade, um continuum de fascículos, uma parte diferente da qual é esticada ao longo da amplitude de movimento. [16] Isso é de grande importância clínica, porque em qualquer posição do joelho, uma porção do LCA permanece sob tensão e funcional.
Recentemente, Zantop et al. sugeriram uma classificação do padrão de ruptura intra-articular do LCA com relação aos seus dois feixes. [20] Esta classificação consiste em um código alfanumérico com letras para a localização da ruptura do feixe AM e números para a localização da ruptura do feixe PL. O local da ruptura femoral para o feixe AM é graduado 1, a ruptura medial da substância é graduada 2 e a ruptura tibial do feixe AM é graduada 3. Um feixe MA insuficiente, funcional alongado é graduado 4 e um feixe AM intacto 5. Para o PL feixe, uma ruptura na origem femoral, a substância intermediária ou a inserção tibial é classificada A, B e C, respectivamente. Os feixes PL alongados são classificados como D e o feixe PL intacto como E. O padrão de ruptura avaliado intraoperatoriamente do feixe AM e PL pode ser expresso usando este código alfanumérico; por exemplo, 1A para uma ruptura femoral do AM e uma ruptura femoral do feixe PL. A validade e confiabilidade de uma possível classificação está atualmente em desenvolvimento.
Micro Anatomia
A complexa organização ultra-estrutural, a orientação variada dos feixes no LCA e o abundante sistema elástico tornam-no muito diferente dos outros ligamentos e tendões. O ACL é uma estrutura única e complexa, capaz de suportar tensões multiaxiais e variações de tensão. [21]
Microscopicamente, podemos distinguir três zonas dentro da ACL:
- A parte proximal , que é menos sólida, é altamente celular, rica em células ovóides e redondas, contendo alguns fibroblastos fusiformes, colágeno tipo II e glicoproteínas, como fibronectina e laminina.
- A parte média , contendo fibroblastos fusiformes e fusiformes, é uma alta densidade de fibras colágenas, uma zona especial de cartilagem e fibrocartilagem (especialmente na parte anterior, onde o ligamento está voltado para a borda anterior da incisura intercondilar), e elástica e oxitânica. fibras. As fibras oxitalânicas suportam modestas tensões multidirecionais, enquanto as fibras elásticas absorvem o estresse máximo recorrente. Os fibroblastos fusiformes e fusiformes são proeminentes nesta parte média, que também é denominada zona fusiforme, e está localizada na parte média e no quarto proximal do ligamento.
- A parte distal , que é a mais sólida, é rica em condroblastos e fibroblastos ovoides, e com baixa densidade de feixes de colágeno. Os fibroblastos, localizados em ambos os lados dos feixes de colágeno, são redondos a ovóides e assemelham-se às células da cartilagem articular. Na porção anterior do LCA, aproximadamente 5 a 10 mm proximal à inserção tibial, uma camada de tecido fibroso denso envolve o ligamento em vez do tecido sinovial. Esta área corresponde à zona onde o ligamento colide com a borda anterior da fossa intercondilar femoral em extensão completa do joelho.
A origem femoral e a inserção tibial têm a estrutura de uma êntese apofisária condral que consiste em quatro camadas. A primeira camada é composta pelas fibras do ligamento. As células fibro-cartilaginosas alinhadas dentro dos feixes de colágeno podem ser encontradas na segunda camada descrita como a zona de cartilagem não mineralizada, enquanto a terceira camada é a zona de cartilagem mineralizada. A fibrocartilagem é mineralizada e insere-se na placa óssea subcondral, que é a quarta camada. [22] Devido a essa anatomia específica das inserções, o LCA mostra uma zona de transição do osso rígido para o tecido ligamentar, permitindo assim uma alteração graduada na rigidez e pode impedir a concentração de tensão no local de inserção. [15][23][8]
O ligamento em si consiste de tecidos conjuntivos densos e é coberto pela membrana sinovial. [24] As fibrilas de colágeno são circundadas por tecido conjuntivo, que forma múltiplos fascículos no LCA. [24] O principal colágeno do LCA é o colágeno tipo I, o tecido conjuntivo frouxo consiste em colágeno tipo III. [25]
Curiosamente, um estudo anatômico revelou diferenças na estrutura do feixe ântero-medial e póstero-lateral. [25] Na parte anterior do feixe anteromedial, a morfologia celular típica é diferente quando comparada com a estrutura típica do restante do LCA. Nesta região, as células não aparecem alongadas. Em extensão total, esta parte do LCA está em contato direto com a fossa intercondilar. [25] Secções histológicas desta área revelam típicos tenócitos e células semelhantes a condrócitos. Essas células condróides produzem até mesmo pequenas quantidades do colágeno Tipo II específico da cartilagem. Por causa do contato direto da cartilagem com o ligamento, o aparecimento de condrócitos poderia ser explicado como uma adaptação funcional do ligamento ao estresse compressivo, que é causado pelo impacto fisiológico entre o LCA e a borda anterior da fossa intercondilar. [25] Utilizando imagens quantitativas de luz polarizada (QPLI), Skelley e colegas [26] relataram maior rigidez e força geral do feixe AM e fibras de colágeno mais fortemente alinhadas quando carregadas.
Recentemente, Lee et al. descobriu que o estrogênio regula diretamente a estrutura e a função ligamentar por meio da alteração da síntese dos tipos I e III. [27][28] De fato, o estrogênio estimula a síntese de colágeno tipo I e III no nível do mRNA, enquanto a aplicação de uma força mecânica diminui a expressão dos genes do colágeno tipos I e III em todos os níveis de estrogênio testados. [27]
A organização paralela, densa e regular das fibrilas do LCA parece ser única. É uma combinação de redes não lineares helicoidais e planares, paralelas ou torcidas. Os fascículos localizados centralmente no LCA são retos ou ondulados em um padrão de onda planar, enquanto aqueles localizados na periferia estão dispostos em um padrão de ondas helicoidais. O objetivo da onda e padrão não linear das fibrilas tem sido interpretado como “crimp” e “recrutamento”, respectivamente. [29] Crimp representa um padrão sinusoidal regular na matriz. Este padrão semelhante a um acordeão na matriz fornece um “tampão” no qual um ligeiro alongamento longitudinal pode ocorrer sem dano fibroso. Também fornece um mecanismo para controle de tensão e atua como um “amortecedor” ao longo do comprimento do tecido. [30] Assim, durante o estiramento de tração, a “crimpagem” da fibrila é primeiramente resolvida por pequenas cargas, após as quais cargas maiores são necessárias para alongar essas fibras. Como tal, um número crescente de fibrilas torna-se mais resistente à medida que cargas maiores são aplicadas (“recrutamento”) e um aumento gradual na rigidez do tecido é observado, resultando em uma curva carga-alongamento não-linear. Esse fenômeno permite que o ACL forneça rapidamente proteção adicional à articulação. [30]
Também recentemente, Chen et al. apresentou um modelo de LCA humano para avaliar os efeitos mecânicos de descarga sobre as alterações histológicas dos tecidos do ligamento ao longo do tempo. [31] Variáveis de teste incluíram densidade de fibroblastos, amplitude de crimpagem e formato nuclear de crimpagem. Os autores observaram as mudanças seqüenciais: a densidade de fibroblastos aumentou significativamente dentro de 5 a 6 semanas após a descarga. Por 7-8 semanas, a amplitude de crimpagem diminuiu significativamente, acompanhada pela formação de padrões de fibras irregulares e fragmentos. Seguiu-se o comprimento de onda de crimpagem e a mudança da forma nuclear de fuso para ovoide em 9 a 14 semanas. De acordo com a literatura, as cargas físicas fornecem um importante estímulo para a manutenção da estrutura e função normais do tecido ligamentar. A expressão gênica de colágeno tipo I e III também é estimulada por estiramento mecânico em células ACL, via up-regulation do fator transformador de crescimento (TGF) -b1. [28] Portanto, os autores enfatizaram o importante conceito de implementação precoce de força mecânica em programas de reabilitação para pacientes com ligamentos lesionados para evitar os efeitos deletérios causados pela descarga mecânica.
Biomecânica
Os feixes de fibras do LCA não funcionam como uma simples faixa de fibras com tensão constante; na verdade, eles mostram um padrão de tensão diferente ao longo de toda a amplitude de movimento. A diferenciação do LCA em dois grupos funcionais, o feixe ântero-medial (AMB) e o feixe posterolateral (PLB), parece uma simplificação excessiva, mas a descrição de dois feixes das fibras do LCA tem sido amplamente aceita como base para o entendimento da função. do ACL. A terminologia dos feixes foi escolhida de acordo com sua inserção tibial com as fibras da BAM originadas na parte mais proximal da origem femoral da BAM e inserindo-se na inserção tibial ântero-medial. [11][23][8][11] Como mencionado anteriormente, o papel da AMB e PLB em restringir a translação anterior da tíbia é determinado por seus padrões de tensão ao longo da flexão-extensão passiva. Sakane et al. demonstraram que, em resposta à carga tibial anterior de 134 N, as forças absorvidas pelo PLB são maiores em graus de flexão mais baixos quando comparadas à AMB. [32] A AMB, no entanto, mostrou absorver mais da força externa aplicada em ângulos de flexão mais altos. [32] Usando um strain gage de metal líquido, Bach et al. relataram maior tensão no PLB do que na AMB na flexão do joelho abaixo de 200. [3] Um estudo biomecânico realizado em cadáveres humanos relatou um aumento insignificante na translação anterior da tíbia após a ruptura parcial dos feixes de AM ou PL [33] . A função recíproca entre os dois grupos permanece inconclusiva na literatura [34] .
Um estudo recente foi realizado utilizando um sensor de momento de força robótico / universal e sublinhou a importância do PLB. [35] Neste estudo, as forças in situ de PLB em resposta a uma carga anterior de 134 N foram maiores em extensão total e diminuíram com o aumento da flexão. [35] Estes autores demonstraram ainda que o PLB desempenha um papel significativo na estabilização do joelho contra uma carga rotatória combinada. [35] Um recente estudo in vivo, utilizando análise estereofotogramétrica radiográfica (ASR), avaliou a cinemática do joelho de seis pacientes submetidos à reconstrução do LCA (técnica de feixe único) e não lesionados (contralateral) durante a descida. [36] Os autores concluíram que a reconstrução do LCA com feixe único falhou em restaurar a cinemática rotacional normal do joelho durante o carregamento dinâmico. Em conclusão, parece haver alguma concordância que favorece a hipótese de que o PLB é mais uma restrição à rotação tibial do que a AMB.
Após a ruptura do LCA, o eixo rotacional do joelho é alterado, comprometendo a instabilidade rotacional interna [37] . Como resultado, o movimento no componente póstero-lateral é aumentado em até 413% a 15 ° de flexão do joelho [38] .
Propriedades Estruturais e Mecânicas
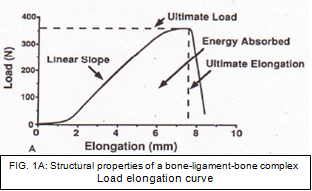
As propriedades estruturais podem ser descritas como as propriedades do ligamento ou tendão juntamente com seu local de inserção e dispositivos de fixação [39], enquanto as propriedades mecânicas podem ser definidas como as propriedades do próprio ligamento ou prótese de substituição sem seus locais de inserção. [30] Quando um complexo fêmur-ACL-tíbia (FATC) é submetido a testes de tração, a curva carga-alongamento resultante representa as propriedades estruturais do FATC (Fig. 1A). A forma da curva depende das propriedades da substância ligamentar, da geometria do complexo e do local de inserção óssea do ligamento. As propriedades estruturais importantes incluem a rigidez linear, carga final, deformação final e energia absorvida na falha (área abaixo da curva). [40]
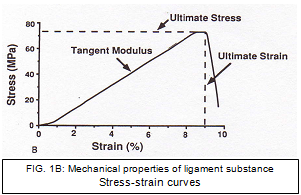
Embora as propriedades estruturais forneçam informações valiosas sobre o FATC, elas não podem nos dizer especificamente sobre o material que compõe o ligamento. As “propriedades mecânicas” da substância ligamentar podem ser derivadas da curva tensão-deformação (Fig. 1B). A partir dos valores da curva de tensão de tensão para módulo, tensão final e deformação, a densidade de energia também pode ser determinada. [39]
As propriedades estruturais e mecânicas do ACL nativo mostraram diminuir com a idade mais alta. [39] A carga máxima média de FATC em indivíduos com idade entre 22 e 35 anos foi de 2.160 (± 157) N. [39] A rigidez de uma reconstrução do LCA ou do FATC nativo pode ser determinada em testes de carga até a falha como a região linear a curva de alongamento de carga. Para os espécimes com idade entre 22 e 35 anos, a rigidez do FATC foi de 242 (± 28) N / mm. [39] A energia absorvida na falha pode ser calculada a partir da área abaixo da curva e para as amostras com idade entre 22 e 35, a energia absorvida na falha foi de 11,6 (± 1,7) Nm. [39]
A configuração geométrica complexa e os feixes de fibras de comprimento diferente do ACL têm dificultado os esforços para calcular o estresse e a tensão. Butler et al. dividiu o ligamento do LCA humano em porções e testou as unidades individuais quanto ao módulo médio e resistência à tração final. [41] O módulo médio e a resistência à tração final mediram 278 e 35 MPa, respectivamente. Os ligamentos atingiram seu estresse final em -15% de tensão. Em um estudo posterior, Butler et al. descobriram que o AMB exibiu um módulo maior, força de tensão final e densidade de energia de deformação do que a porção posterior. [42]
Os dois enxertos mais utilizados são os tendões osso-patelar-osso (BPTB) e os isquiotibiais como enxerto de tendão autólogo. O objetivo da seleção do enxerto deve ser a correspondência da curva carga-alongamento dos enxertos do LCA com a curva gerada pelo FATC humano. As propriedades estruturais de um enxerto de tendão patelar de 10 mm de largura foram relatadas como comparáveis às do ACL nativo, com uma força de ruptura final média de 1.784 (± 580) N e uma rigidez média de 210 N / mm. [43] A análise biomecânica de um enxerto de isquiotibiais quádruplo revelou uma carga e rigidez máximas médias de 2.422 (± 538) N e 238 N / mm, respectivamente. [43] No entanto, essas investigações foram realizadas no momento zero e estudos em animais mostraram que as propriedades estruturais das reconstruções do LCA diminuem devido à cicatrização e remodelação do enxerto. Weiler et al. mostraram em um modelo de ovinos que a resistência à tração de um enxerto de tecido mole fixado com fixação de parafuso de interferência cai para 6,9% daquele no ponto zero e pode levar até 12 semanas até o nível de força encontrado no momento da reconstrução (tempo ponto zero) é atingido novamente. [44]
Efeitos da estabilização muscular
Os músculos que cruzam o joelho desempenham um papel importante na manutenção da cinemática normal do joelho intacto. A atividade muscular pode introduzir grandes mudanças nas tensões e forças experimentadas pelo LCA. [7] Markolf et al. descobriram que a extensão passiva do joelho gerou forças no LCA somente durante os últimos 100 ° de extensão, enquanto que as forças do tendão do quadríceps de 200N no LCA causaram forças no LCA a aumentar em todos os ângulos de flexão do joelho. [19] Tem sido demonstrado que as forças do músculo quadríceps induzem aumento da translação anterior da tíbia, enquanto as forças musculares dos isquiotibiais têm o efeito oposto. Com as forças do quadríceps e isquiotibiais, as cepas da porção AM não são diferentes do que no joelho sem carga em todos os ângulos de flexão do joelho. [45] Com base nas equações de equilíbrio de força e dados geométricos de radiografias de joelhos saudáveis, Yasuda e Sasaki propuseram que os músculos quadríceps e isquiotibiais pudessem ser contatados simultaneamente com o joelho quase totalmente estendido sem produzir uma força anterior grande. [46] No geral, estudos sugerem que movimentos passivos de flexo-extensão, como movimento passivo contínuo, variando de 100 ° de flexão a flexão total, são seguros para a reabilitação do joelho imediatamente após a reconstrução do LCA. Os movimentos ativos de flexão-extensão devem ser limitados a 50 ° e 100 °. A contração isométrica do quadríceps deve começar em ou maior que 70 °. O quadríceps e os isquiotibiais podem ser co-contratados com segurança em qualquer ângulo de flexão, exceto na extensão total. [47]
Andar de andar, subir e descer escadas foram encontrados para exercer as maiores forças de cisalhamento no LCA em comparação com outras atividades, como sentar-se, de pé e atividades de flexão do joelho [48] .
Recentemente, Zaffagnini et al. realizaram uma avaliação histológica qualitativa e quantitativa, por microscopia eletrônica de transmissão (MET), do processo de neoligamentação de um enxerto autólogo de osso-tendão patelar-osso (BTPB) utilizado como pró-LCA em diferentes tempos de seguimento. [49] Seus resultados mostraram que, até 24 meses de acompanhamento, alterações ultraestruturais progressivas em direção ao LCA normal são observadas. Em tempos mais longos após a cirurgia (48 e 120 meses), nenhuma outra alteração foi evidenciada e a ultraestrutura mostrou uma redução acentuada em fibrilas grandes, o que era típico do controle do tendão patelar, e um aumento significativo de fibrilas pequenas. A ultraestrutura parecia combinar fibrilas de duas unidades morfológicas diferentes. O enxerto BPTB usado como ACL passou por um processo de transformação por até dois anos. Após esse período a transformação cessou e por dez anos não conseguiu atingir o aspecto ultraestrutural de um LCA normal. No entanto, do ponto de vista arquitetônico, o enxerto transformou-se lentamente em uma estrutura semelhante ao LCA com relação às diferentes tensões mecânicas que o ligamento tem que sustentar. [49] Estudo semelhante com enxerto de isquiotibiais autólogo está em andamento.
Além disso, Okahashi et al. avaliaram recentemente se os tendões dos isquiotibiais podem se regenerar após a colheita para reconstrução do ligamento cruzado anterior (LCA) e se o tecido regenerado pode ser histologicamente caracterizado como tendíneo. Em seu estudo, a regeneração do tendão foi detectada macroscopicamente em 9 dos 11 pacientes. Histologicamente e imuno-histoquimicamente, os tendões regenerados assemelhavam-se aos normais. Os resultados deste estudo mostram que os tendões dos isquiotibiais podem regenerar após a colheita para a reconstrução do LCA. [50] No entanto, o uso de enxertos de isquiotibiais para a reconstrução do LCA pode levar a diferentes padrões histológicos de cicatrização de tendões e ossos. Micromoção do enxerto isquiotibial dentro do canal perfurado pode desempenhar um papel na cicatrização do tendão-osso. [51]
Um estudo que investigou as características moleculares dos extensores do joelho após a reconstrução do LCA encontrou reduzido percentual de fibras lentas, menor densidade de fibras mitocondriais e relação capilar-fibra, particularmente no músculo vasto lateral até 5 anos após a cirurgia [52] .
Referências
- Matsumoto, H., Suda, Y., Otani, T., Niki, Y., Seedhom, BB, Fujikawa, K. (2001). ↑ 1,01,1 Matsumoto, H., Suda, Y., Otani, T., Niki, Y., Seedhom, BB, Fujikawa, K. (2001). Funções do ligamento cruzado anterior e do ligamento colateral medial na prevenção da instabilidade em valgo. J Orthop Sci, 6 (1), 28-32.
- Van Den Bogert, AJ, McLean, SG (2007). ↑ Van Den Bogert, AJ, McLean, SG (2007). Lesões do LCA: sabemos os mecanismos? J Orthop Sports Phys Ther, 37 (2), A8-9.
- Bach, BR, Jr., Levy, ME, Bojchuk, J., Tradonsky, S., Bush-Joseph, CA, Khan, NH (1998). ↑ 3,03,1 Bach, BR Jr., Levy, ME, Bojchuk, J., Tradonsky, S., Bush-Joseph, CA, Khan, NH (1998). Reconstrução do ligamento cruzado anterior endoscópico de incisão única com autoenxerto do tendão patelar. Avaliação mínima de acompanhamento de dois anos. Am J Sports Med, 26 (1), 30-40.
- Freedman, KB, D’Amato, MJ, Nedeff, DD, Kaz, A., Bach, BR, Jr. (2003). ↑ Freedman, KB, D’Amato, MJ, Nedeff, DD, Kaz, A., Bach, BR, Jr. (2003). Reconstrução do ligamento cruzado anterior por via artroscópica: meta-análise comparando o auto-enxerto do tendão patelar e do isquiotibial. Am J Sports Med, 31 (1), 2-11.
- Lohmander, LS, Ostenberg, A., Englund, M., Roos, H. (2004). ↑ 5.05.1 Lohmander, LS, Ostenberg, A., Englund, M., Roos, H. (2004). Alta prevalência de osteoartrose do joelho, dor e limitações funcionais em futebolistas do sexo feminino, doze anos após a lesão do ligamento cruzado anterior. Arthritis Rheum, 50 (10), 3145-3152.
- Petersen, W., Laprell, H. (2000). ↑ Petersen, W., Laprell, H. (2000). Inserção de enxerto de tendão autólogo ao osso: estudo histológico e imuno-histoquímico de enxertos de isquiotibiais e tendões patelares. Knee Surg Sports Traumatol Arthrosc, 8 (1), 26-31.
- Zantop, T., Petersen, W., Sekiya, JK, Musahl, V., Fu, FH (2006). ↑ 7,07,17,27,37,4 Zantop, T., Petersen, W., Sekiya, JK, Musahl, V., Fu, FH (2006). Anatomia do ligamento cruzado anterior e função relacionada à reconstrução anatômica. Knee Surg Sports Traumatol Arthrosc, 14 (10), 982-992.
- Petersen, W., Tillmann, B. (2002). ↑ 8,08,18 Petersen, W., Tillmann, B. (2002). Anatomia e função do ligamento cruzado anterior. Orthopade, 31 (8), 710-718.
- Tena-Arregui, J., Barrio-Asensio, C., Viejo-Tirado, F., Puerta-Fonolla, J., Murillo-Gonzalez, J. (2003). ↑ Tena-Arregui, J., Barrio-Asensio, C., Viejo-Tirado, F., Puerta-Fonolla, J., Murillo-Gonzalez, J. (2003). Estudo artroscópico da articulação do joelho em fetos. Arthroscopy, 19 (8), 862-868.
- Ellison, AE, Berg, EE (1985). ↑ Ellison, AE, Berg, EE (1985). Embriologia, anatomia e função do ligamento cruzado anterior. Orthop Clin North Am, 16 (1), 3-14.
- Girgis, FG, Marshall, JL, Monajem, A. (1975). 11,011,111,211,311,411,511,611,7 Girgis, FG, Marshall, JL, Monajem, A. (1975). Os ligamentos cruzados da articulação do joelho. Análise anatômica, funcional e experimental. Clin Orthop Relat Res (106), 216-231.
- Amis, AA, Dawkins, GP (1991). ↑ 12,012,1 Amis, AA, Dawkins, GP (1991). Anatomia funcional do ligamento cruzado anterior. Ações do feixe de fibras relacionadas a reposições e lesões ligamentares. J Bone Joint Surg Br, 73 (2), 260-267.
- Harner, CD, Livesay, GA, Kashiwaguchi, S., Fujie, H., Choi, NY, Woo, SL (1995). ↑ Harner, CD, Livesay, GA, Kashiwaguchi, S., Fujie, H., Choi, Nova Iorque, Woo, SL (1995). Estudo comparativo do tamanho e forma dos ligamentos cruzados anteriores e posteriores humanos. J Orthop Res, 13 (3), 429-434.
- Harner, CD, Baek, GH, Vogrin, TM, Carlin, GJ, Kashiwaguchi, S., Woo, SL (1999). ↑ Harner, CD, Baek, GH, Vogrin, TM, Carlin, GJ, Kashiwaguchi, S., Woo, SL (1999). Análise quantitativa das inserções do ligamento cruzado humano. Arthroscopy, 15 (7), 741-749.
- Arnoczky, SP (1983). 15,015,1 Arnoczky, SP (1983). Anatomia do ligamento cruzado anterior. Clin Orthop Relat Res (172), 19-25.
- Welsh, RP (1980). 16,016,1 Welsh, RP (1980). Estrutura e função articular do joelho. Clin Orthop Relat Res (147), 7-14.
- Hollis, JM, Takai, S., Adams, DJ, Horibe, S., Woo, SL (1991). ↑ Hollis, JM, Takai, S., Adams, DJ, Horibe, S., Woo, SL (1991). Os efeitos do movimento do joelho e carga externa no comprimento do ligamento cruzado anterior (LCA): um estudo cinemático. J Biomech Eng, 113 (2), 208-214.
- Otsubo H, Akatsuka Y, Takashima H, Suzuki T, Suzuki D, Kamiya T, Ikeda Y, Matsumura T, Yamashita T, Shino K. MRI depiction and 3D visualization of three anterior cruciate ligament bundles. ↑ Otsubo H, Y de Akatsuka, Takashima H, T de Suzuki, Suzuki D, Kamiya T, I de Ikeda, Matsumura T, Yamashita T, representação de Shino K. MRI e visualização 3D de três pacotes do ligamento cruzado anterior. Anatomia Clínica. 2017 Mar; 30 (2): 276-83.
- Markolf, KL, Mensch, JS, Amstutz, HC (1976). 19,019,1 Markolf, KL, Mensch, JS, Amstutz, HC (1976). Rigidez e frouxidão do joelho – as contribuições das estruturas de suporte. Um estudo in vitro quantitativo. J Bone Joint Surg Am, 58 (5), 583-594.
- Zantop, T., Brucker, PU, Vidal, A., Zelle, BA, Fu, FH (2007). ↑ Zantop, T., Brucker, PU, Vidal, A., Zelle, BA, Fu, FH (2007). Padrão de ruptura intra-articular do LCA. Clin Orthop Relat Res, 454, 48-53.
- Zaffagnini, S., Golano, P., Farinas, O., Depasquale, V., Strocchi, R., Cortecchia, S., et al. ↑ Zaffagnini, S., Golano, P., Farinas, O., Depasquale, V., Strocchi, R., Cortecchia, S., et al. (2003). Vascularidade e neurorreceptores da pata anserina: estudo anatômico. Clin Anat, 16 (1), 19-24.
- Fu, FH, Bennett, CH, Lattermann, C., Ma, CB (1999). ↑ Fu, FH, Bennett, CH, Lattermann, C., Ma, CB (1999). Tendências atuais na reconstrução do ligamento cruzado anterior. Parte 1: Biologia e biomecânica da reconstrução. Am J Sports Med, 27 (6), 821-830.
- Dienst, M., Burks, RT, Greis, PE (2002). 23,023,1 Dienst, M., Burks, RT, Greis, PE (2002). Anatomia e biomecânica do ligamento cruzado anterior. Orthop Clin North Am, 33 (4), 605-620.
- Pitaru, S., Aubin, JE, Bhargava, U., Melcher, AH (1987). 24,024,1 Pitaru, S., Aubin, JE, Bhargava, U., Melcher, AH (1987). Estudos microscópicos imunoeletrônicos sobre as distribuições de fibronectina e actina em um tecido conjuntivo denso celular: o ligamento periodontal do rato. J Periodontal Res, 22 (1), 64-74.
- Petersen, W., Tillmann, B. (1999). 25,025,125,225,3 Petersen, W., Tillmann, B. (1999). Estrutura e vascularização dos ligamentos cruzados da articulação do joelho humano. Anat Embryol (Berl), 200 (3), 325-334.
- Skelley NW, Lake SP, Brophy RH. ↑ Skelley NW, Lago SP, Brophy RH. Propriedades microestruturais do ligamento cruzado anterior. Anais de articulação. 2017 23 de maio, 2 (5).
- Kim, SG, Akaike, T., Sasagaw, T., Atomi, Y., Kurosawa, H. (2002). ↑ 27,027,1 Kim, SG, Akaike, T., Sasagaw, T., Atomi, Y., Kurosawa, H. (2002). Expressão gênica de colágeno tipo I e tipo III por estiramento mecânico em células do ligamento cruzado anterior. Cell Struct Funct, 27 (3), 139-144.
- Lee, CY, Smith, CL, Zhang, X., Hsu, HC, Wang, DY, Luo, ZP (2004). 28,028,1 Lee, CY, Smith, CL, Zhang, X., Hsu, HC, Wang, DY, Luo, ZP (2004). Forças de tração atenuam a síntese de colágeno estimulada por estrogênio no LCA. Biochem Biophys Res Commun, 317 (4), 1221-1225.
- Smith, BA, Livesay, GA, Woo, SL (1993). ↑ Smith, BA, Livesay, GA, Woo, SL (1993). Biologia e biomecânica do ligamento cruzado anterior. Clin Sports Med, 12 (4), 637-670.
- Woo, SL, Gomez, MA, Seguchi, Y., Endo, CM, Akeson, WH (1983). 30,030,130,2 Woo, SL, Gomez, MA, Seguchi, Y., Endo, CM, Akeson, WH (1983). Medição das propriedades mecânicas da substância ligamentar de uma preparação osso-ligamento-osso. J Orthop Res, 1 (1), 22-29.
- Chen, CH, Liu, X., Yeh, ML, Huang, MH, Zhai, Q., Lowe, WR, et al. ↑ Chen, CH, Liu, X., Yeh, ML, Huang, MH, Zhai, Q., Lowe, WR, et ai. (2007). Alterações patológicas do ligamento humano após descarga mecânica completa. Am J Phys Med Rehabil, 86 (4), 282-289.
- Sakane, M., Fox, RJ, Woo, SL, Livesay, GA, Li, G., & Fu, FH (1997). 32,032,1 Sakane, M., Fox, RJ, Woo, SL, Livesay, GA, Li, G., e Fu, FH (1997). Forças in situ no ligamento cruzado anterior e seus feixes em resposta a cargas tibiais anteriores. J Orthop Res, 15 (2), 285-293.
- Kondo E, Merican AM, Yasuda K, Amis AA. ↑ Kondo E, Merican AM, Yasuda K e Amis AA. Análise biomecânica da frouxidão do joelho com ligamento cruzado anterior deficiente do feixe ântero-medial ou póstero-lateral. Artroscopia: O Jornal de Cirurgia Artroscópica e Relacionada. 1 de mar de 2014; 30 (3): 335-43.
- Domnick C, Raschke MJ, Herbort M. Biomechanics of the anterior cruciate ligament: Physiology, rupture and reconstruction techniques. ↑ Domnick C, Raschke MJ, Herbort M. Biomecânica do ligamento cruzado anterior: técnicas de fisiologia, ruptura e reconstrução. Revista mundial de ortopedia. 2016 18 de fevereiro; 7 (2): 82.
- Gabriel, MT, Wong, EK, Woo, SL, Yagi, M., Debski, RE (2004). 35,035,135,2 Gabriel, MT, Wong, EK, Woo, SL, Yagi, M., Debski, RE (2004). Distribution of in situ forces in the anterior cruciate ligament in response to rotatory loads. J Orthop Res, 22(1), 85-89.
- ↑ Tashman, S., Collon, D., Anderson, K., Kolowich, P., Anderst, W. (2004). Abnormal rotational knee motion during running after anterior cruciate ligament reconstruction. Am J Sports Med, 32(4), 975-983.
- ↑ Amis AA, Bull AM, Lie DT. Biomechanics of rotational instability and anatomic anterior cruciate ligament reconstruction. Operative Techniques in Orthopaedics. 2005 Jan 1;15(1):29-35.
- ↑ Kanamori A, Sakane M, Zeminski J, Rudy TW, Woo SL. In-situ force in the medial and lateral structures of intact and ACL-deficient knees. Journal of orthopaedic science. 2000 Nov 1;5(6):567-71.
- ↑ 39.039.139.239.339.439.5 Woo, SL, Hollis, JM, Adams, DJ, Lyon, RM, Takai, S. (1991). Tensile properties of the human femur-anterior cruciate ligament-tibia complex. The effects of specimen age and orientation. Am J Sports Med, 19(3), 217-225.
- ↑ Takeda, Y., Xerogeanes, JW, Livesay, GA, Fu, FH, Woo, SL (1994). Biomechanical function of the human anterior cruciate ligament. Arthroscopy, 10(2), 140-147.
- ↑ Butler, DL, Kay, MD, Stouffer, DC (1986). Comparison of material properties in fascicle-bone units from human patellar tendon and knee ligaments. J Biomech, 19(6), 425-432.
- ↑ Butler, DL, Guan, Y., Kay, MD, Cummings, JF, Feder, SM, Levy, MS (1992). Location-dependent variations in the material properties of the anterior cruciate ligament. J Biomech, 25(5), 511-518.
- ↑ 43.043.1 Wilson, TW, Zafuta, MP, Zobitz, M. (1999). A biomechanical analysis of matched bone-patellar tendon-bone and double-looped semitendinosus and gracilis tendon grafts. Am J Sports Med, 27(2), 202-207.
- ↑ Weiler, A., Hoffmann, RF, Bail, HJ, Rehm, O., Sudkamp, NP (2002). Tendon healing in a bone tunnel. Part II: Histologic analysis after biodegradable interference fit fixation in a model of anterior cruciate ligament reconstruction in sheep. Arthroscopy, 18(2), 124-135.
- ↑ Draganich, LF, Vahey, JW (1990). An in vitro study of anterior cruciate ligament strain induced by quadriceps and hamstrings forces. J Orthop Res, 8(1), 57-63.
- ↑ Yasuda, K., Sasaki, T. (1987). Exercise after anterior cruciate ligament reconstruction. The force exerted on the tibia by the separate isometric contractions of the quadriceps or the hamstrings. Clin Orthop Relat Res(220), 275-283.
- ↑ Dubljanin-Raspopovic, E., Kadija, M., Matanovic, D. (2005). [Basic principles of aggressive rehabilitation after anterior cruciate ligament reconstruction]. Srp Arh Celok Lek, 133(11-12), 528-531.
- ↑ Marieswaran M, Jain I, Garg B, Sharma V, Kalyanasundaram D. A Review on Biomechanics of Anterior Cruciate Ligament and Materials for Reconstruction. Applied bionics and biomechanics. 2018;2018.
- ↑ 49.049.1 Zaffagnini, S., De Pasquale, V., Marchesini Reggiani, L., Russo, A., Agati, P., Bacchelli, B., et al. (2007). Neoligamentization process of BTPB used for ACL graft: histological evaluation from 6 months to 10 years. Knee, 14(2), 87-93.
- ↑ Okahashi, K., Sugimoto, K., Iwai, M., Oshima, M., Samma, M., Fujisawa, Y., et al. (2006). Regeneration of the hamstring tendons after harvesting for arthroscopic anterior cruciate ligament reconstruction: a histological study in 11 patients. Knee Surg Sports Traumatol Arthrosc, 14(6), 542-545.
- ↑ Nebelung, W., Becker, R., Urbach, D., Ropke, M., Roessner, A. (2003). Histological findings of tendon-bone healing following anterior cruciate ligament reconstruction with hamstring grafts. Arch Orthop Trauma Surg, 123(4), 158-163.
- ↑ Flück M, Viecelli C, Bapst AM, Kasper S, Valdivieso P, Franchi MV, Ruoss S, Lüthi JM, Bühler M, Claassen H, Hoppeler H. Knee extensors muscle plasticity over a 5-years rehabilitation process after open knee surgery. Frontiers in physiology. 2018;9.